在微生物学领域,细菌与宿主细胞的相互作用一直是研究的热点。军团菌作为一种新的研究病原菌和宿主相互作用机制的重要模式生物,其与宿主细胞互作过程的探究不仅揭示了胞内寄生菌与宿主先天性免疫系统间的复杂信号调控机制,也为探索布氏杆菌、结核分枝杆菌、志贺氏菌、伤寒沙门氏菌等其它重要胞内寄生菌的致病机制提供了重要启示。
2024年9月30日,吉林大学邱家章教授团队在学术期刊《Nature Communications》上发表,题为“Phosphorylation of caspases by a bacterial kinase inhibits host programmed cell death”的研究论文。
该研究旨在深度探索嗜肺军团菌如何操纵宿主细胞凋亡途径。研究人员发现激酶LegK3是嗜肺军团菌感染宿主细胞过程中的一个重要调节因子,能够抑制宿主细胞凋亡(图1)。
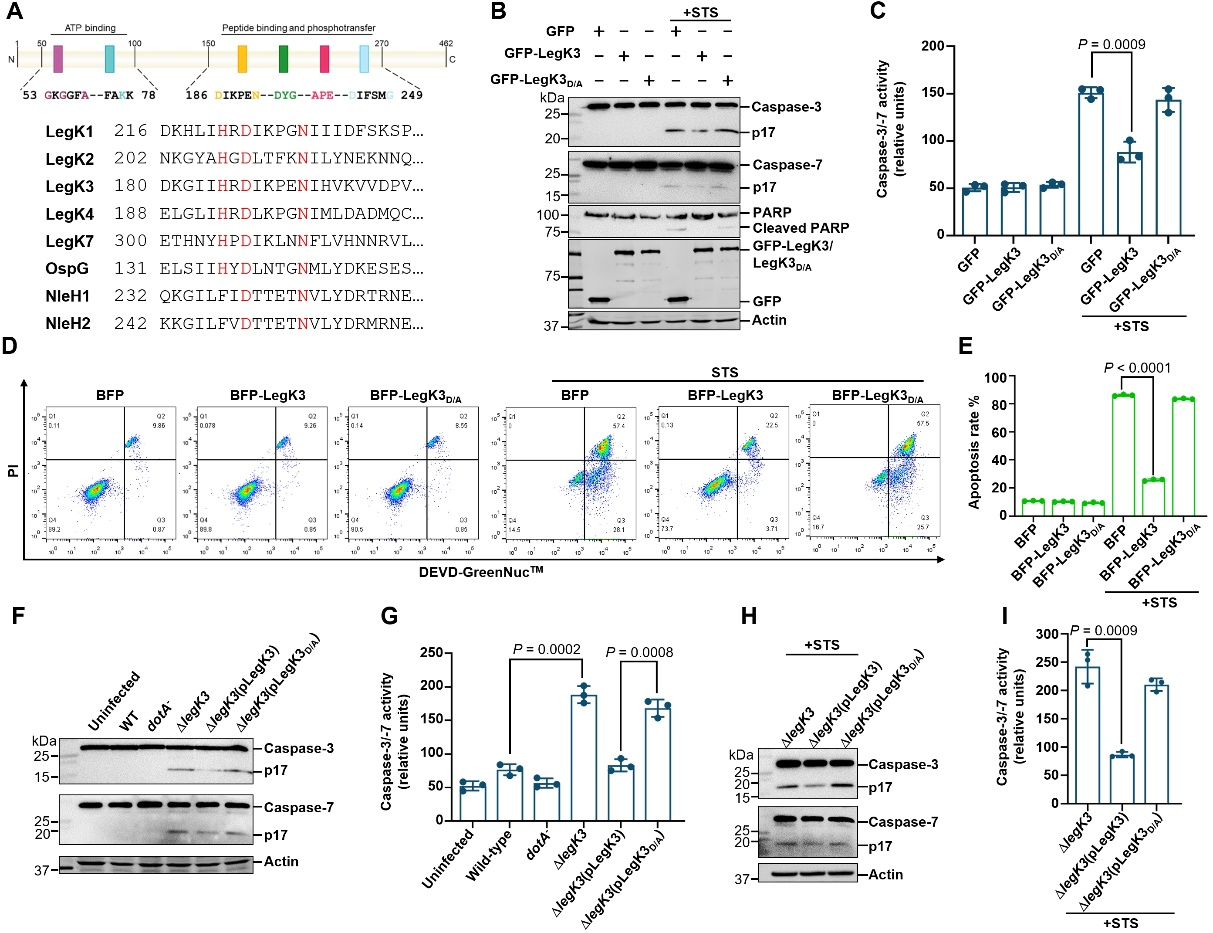
图1. LegK3抑制细胞凋亡且依赖其激酶活性
进一步的机制研究表明,LegK3能够直接磷酸化多种参与凋亡信号转导的胱天蛋白酶,包括Caspase-3、Caspase-7和Caspase-9。研究人员通过磷酸化质谱鉴定到LegK3催化的胱天蛋白酶的磷酸化修饰位于前域或功能域间的丝氨酸(Caspase-3中的Ser29和Caspase-7中的Ser199)或苏氨酸(Caspase-9中的Thr102)残基上。
通过生化以及细胞生物学等多种实验,研究人员发现磷酸化修饰会干扰胱天蛋白酶作为起始胱天蛋白酶或上游调节因子底物的适用性,但不会影响其蛋白水解活性。进一步研究发现这种磷酸化修饰不仅能够抑制细胞凋亡,还能够抑制细胞焦亡(图2),这两种程序性细胞死亡途径的调控对于嗜肺军团菌在宿主细胞内的生存和繁殖至关重要。
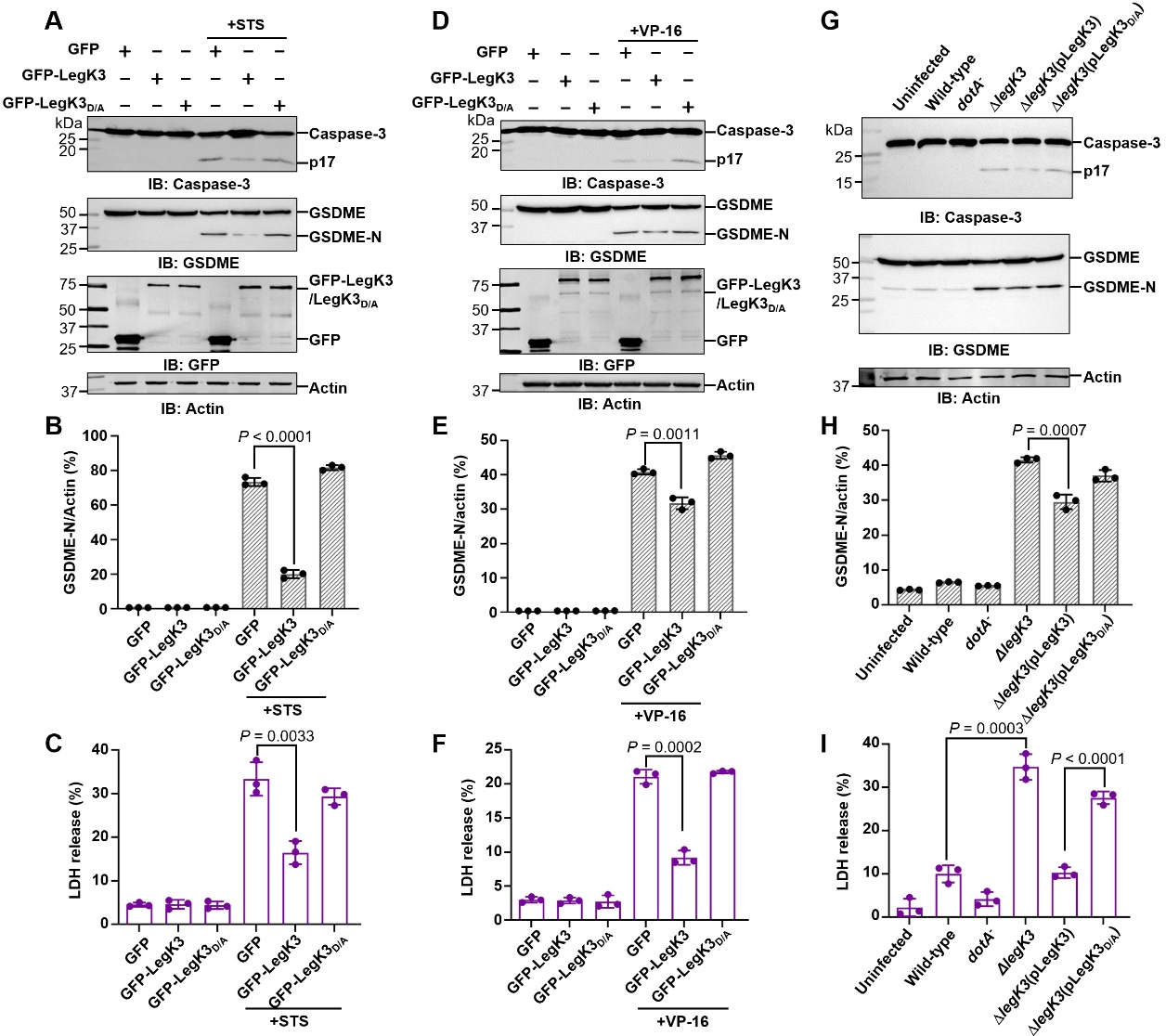
图2. LegK3抑制Caspase-3和GSDME诱导的焦亡
综上所述,该研究证实了嗜肺军团菌效应蛋白LegK3是已知的第一个通过磷酸化劫持胱天蛋白酶的细菌毒力因子。同时,该研究也系统的阐述了效应蛋白LegK3通过模拟真核细胞激酶功能,靶向多种胱天蛋白酶来扰乱宿主细胞程序性死亡途径的分子机制(图3)。这对进一步了解嗜肺军团菌致病机制具有重大意义,也为之后开发新型抗感染药物以及治疗相关疾病提供理论基础。
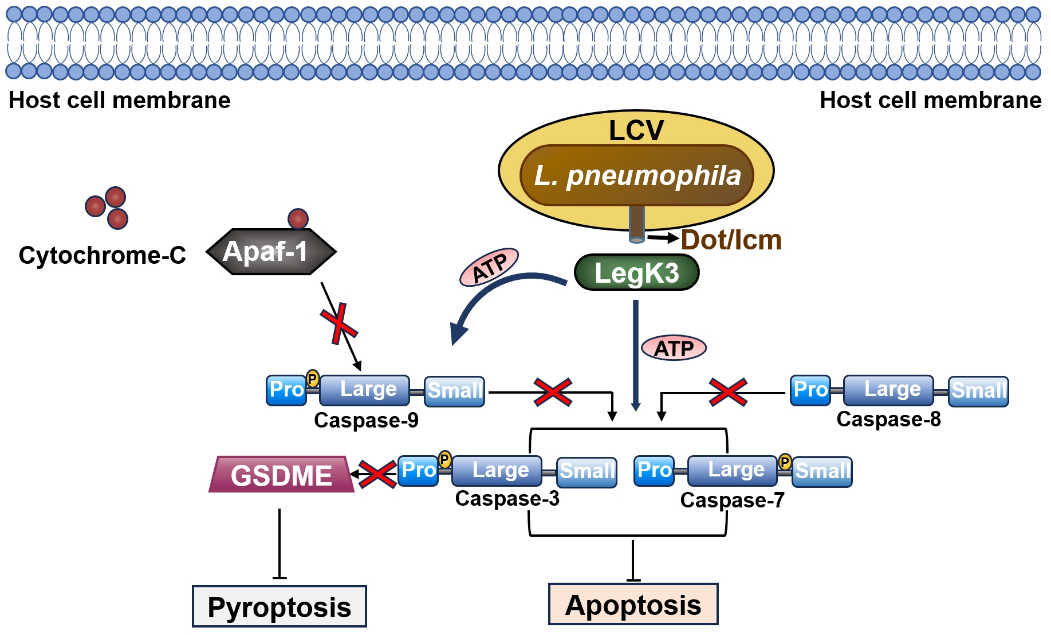
图3. LegK3抑制程序性细胞死亡的模式图
吉林大学动物医学学院博士研究生葛津利和北京大学医学部基础医学院博士研究生王颖为共同第一作者,邱家章教授和刘小云教授为共同通讯作者。该研究得到国家自然科学基金面上项目的资助。
原文链接:
https://www.nature.com/articles/s41467-024-52817-1
相关图片:
